
SEPLIFE ®, Alles, was Sie über Ionenaustauschchromatographie wissen müssen
Einführung in die Ionenaustauschchromatographie:
Die Ionenaustauschchromatographie ist ein Säulenchromatographieverfahren, das den Unterschied der elektrostatischen Kraft zwischen den austauschbaren Ionen auf dem Ionenaustauscher und den verschiedenen im umgebenden Medium getrennten Ionen ausnutzt und die Trennung durch Austauschgleichgewicht erreicht. Die Ionenaustauschchromatographie bietet die Vorteile hoher Empfindlichkeit, Wiederholbarkeit, guter Selektivität und schneller Analysegeschwindigkeit und ist derzeit eine der am häufigsten verwendeten Chromatographiemethoden.
1848 entdeckten Thompson et al. das Phänomen des Ionenaustauschs bei der Untersuchung des Austauschs alkalischer Substanzen im Boden. In den 1940er Jahren erschienen Polystyrol-Ionenaustauscherharze mit stabilen Austauscheigenschaften. In den 1950er Jahren hielt die Ionenaustauschchromatographie Einzug in die Biochemie und wurde zur Analyse von Aminosäuren eingesetzt. Auch heute noch ist die Ionenaustauschchromatographie ein gängiges Chromatographieverfahren in der Biochemie und wird häufig zur Trennung und Reinigung verschiedener biochemischer Substanzen wie Aminosäuren, Proteinen, Zuckern, Viren und Nukleotiden eingesetzt.
Der Ionenaustauschprozess:
Die Reaktion zwischen dem Ionenaustauscher und den Ionen oder ionischen Verbindungen in der Lösung erfolgt hauptsächlich durch Ionenaustausch. Die durchgeführte Ionenaustauschreaktion ist reversibel. Unter der Annahme, dass RA den Kationenaustauscher darstellt, kann das in der Lösung dissoziierte Kation A+ eine reversible Austauschreaktion mit dem Kation B+ in der Lösung eingehen. Die Reaktionsformel lautet:
RA + B+ – RB + A+
Die Reaktion erreicht das Gleichgewicht mit extrem hoher Geschwindigkeit und die Gleichgewichtsverschiebung folgt dem Massenwirkungsgesetz.
Die Selektivität eines Ionenaustauschers kann durch die Gleichgewichtskonstante K seiner Reaktion ausgedrückt werden:
K锛漑RB][A+]/[RA][B+]
✔Wenn [A+] gleich [B+] in der Reaktionslösung ist, dann ist K=[RB]/[RA].
✔Wenn K>1, also [RB]>[RA], bedeutet dies, dass die Bindungskraft des Ionenaustauschers an B+ größer ist als die von A+;
✔Wenn K=1, also [RB]=[RA], bedeutet dies, dass der Ionenaustauscher die gleiche Bindungskraft für A+ und B+ hat;
✔Wenn K
✔Der K-Wert ist ein Parameter, der die Bindungskraft oder Selektivität des Ionenaustauschers gegenüber verschiedenen Ionen widerspiegelt, daher wird der K-Wert als Selektivitätskoeffizient des Ionenaustauschers für A+ und B+ bezeichnet.
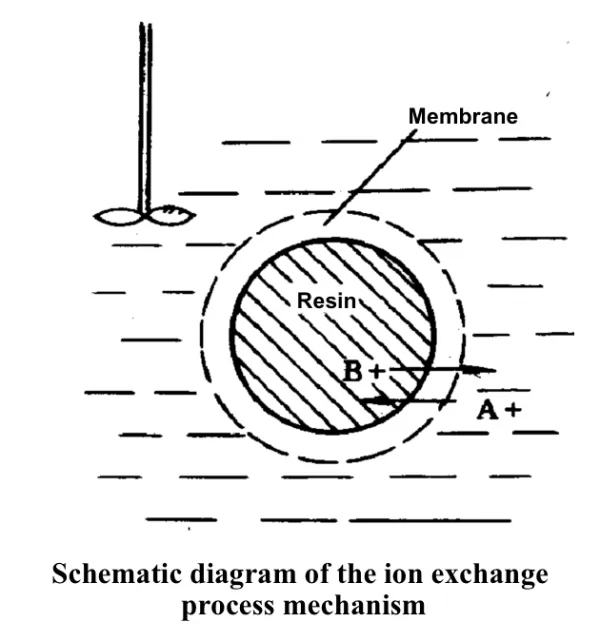
Mechanismus des Ionenaustauschs:
A+ diffundiert aus der Lösung zur Harzoberfläche.
A+ gelangt von der Harzoberfläche in das aktive Zentrum im Inneren des Harzes.
A+ unterliegt einer Metathesereaktion mit RB am aktiven Zentrum.
Das desorbierte Ion B+ diffundiert aus dem Inneren des Harzes an die Oberfläche des Harzes.
B+-Ionen diffundieren von der Harzoberfläche in die Lösung.
Der steuernde Schritt der Austauschrate ist die Diffusionsrate, die in verschiedenen Trennsystemen durch interne oder externe Diffusion gesteuert werden kann.
Faktoren, die den Ionenaustauschprozess beeinflussen:
✔Partikelgröße: Je kleiner, desto schneller
✔Vernetzungsgrad: geringer Vernetzungsgrad, schnelle Austauschgeschwindigkeit
✔Temperatur: Je höher, desto schneller, hängt mit der Erhöhung des Diffusionskoeffizienten zusammen
✔Ionenvalenz: Je höher die Valenz, desto langsamer die Diffusionsrate
✔Ionengröße: je kleiner, desto schneller
✔ Rührgeschwindigkeit: bis zu einem gewissen Grad, je größer desto schneller
✔Lösungskonzentration: Wenn die Austauschrate durch Diffusion gesteuert wird, ist die Austauschrate umso schneller, je höher die Konzentration ist
Prinzip des Ionenaustauschs:
Bei der Wahl eines Kationenaustauscherharzes wird die positiv geladene Substanz gegen H+ ausgetauscht und an das Harz gebunden. Bei der Wahl eines Anionenaustauscherharzes kann die negativ geladene Substanz gegen OH- ausgetauscht und an das Harz gebunden werden.
Es gibt Unterschiede im Festigkeitsgrad der Substanzkombination auf dem Harz, und die Komponenten in der Mischung können durch Auswahl eines geeigneten Elutionsmittels einzeln eluiert werden, um den Zweck der Trennung und Reinigung zu erreichen.
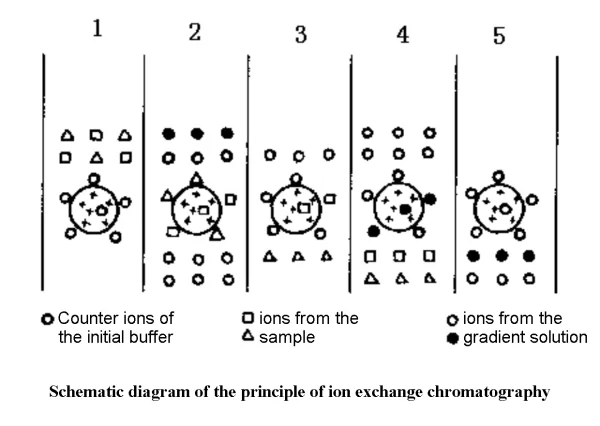
✔1. Äquilibrierungsstufe: Kombination aus Ionenaustauscher und Gegenionen
✔2. Adsorptionsphase: Proben- und Gegenionenaustausch
✔3. Desorptionsphase: Die Gradientenpufferlösung wäscht zuerst die schwach adsorbierten Substanzen ab und wäscht dann die stark adsorbierten Substanzen ab
✔4. Regenerationsphase: Vollständiges Waschen mit der ursprünglichen Balance-Lösung, die wiederverwendet werden kann
Ionenaustauschchromatographieharze:
Die geladenen Gruppen von Kationenaustauschern sind negativ geladen und die Gegenionen sind positiv geladen, wodurch sie Austauschreaktionen mit Kationen oder positiv geladenen Verbindungen in der Lösung durchführen können.
Je nach Stärke der geladenen Gruppe kann man sie in drei Typen unterteilen, nämlich in den starken Säuretyp (Gruppe mit Sulfonsäure, R-SO3H), den mittelstarken Säuretyp (enthält Phosphorsäuregruppe oder Phosphorigsäuregruppe, R-PO3H2) und den schwachen Säuretyp (mit Carboxylgruppe und Phenolharz, R-COOH oder R-Benzolring-OH).
Beim Austausch dieser Austauscher werden die Wasserstoffionen durch Fremdkationen ersetzt, wie in der folgenden Formel dargestellt:
R锛岰OOH锛婲a+锛漅锛岰OONa锛嬶紜H+
Der Anionenaustauscher wird durch die Einführung von quaternären Amin- [-N(CH3)3]-, tertiären Amin- [-N(CH3)2]-, sekundären Amin- [-NHCH3]- und primären Amin- [-NH2]-Gruppen auf der Matrix gebildet.
Entsprechend dem unterschiedlichen Grad der Alkalität der Amingruppen können diese in drei Typen unterteilt werden: stark basisch (einschließlich quaternärer Aminogruppen), schwach basisch (einschließlich tertiärer und sekundärer Aminogruppen) und mittelbasisch (enthält sowohl stark basische als auch schwach basische Gruppen).
Beim Austausch mit Ionen in der Lösung lautet die Reaktionsformel wie folgt:
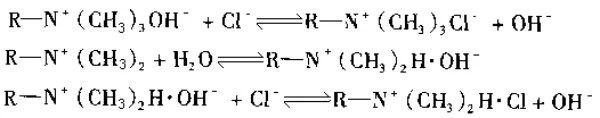
Weitere Informationen zu den spezifischen Arten von Ionenaustauschchromatographieharzen finden Sie in unserem nächsten Artikel zur Ionenaustauschchromatographie.















